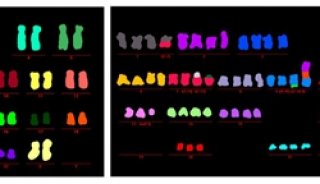
应用细胞融合技术制备染色体提前凝集标本
实验概要
通过细胞融合技术,初步了解染色体提前凝集标本制备原理、方法及间期细胞三种时相的提前凝集染色体特点。
实验原理
在自然条件下或用人工的方法(物理、化学或生物)将两个或两个以上的同种或不同种细胞融合成一个细胞的过程称为细胞融合。
七十年代初,由于发现M 期细胞内有某种促进染色体凝集因子,它无种属特异性,所以在细胞融合和染色体技术的基础上,建立了制备染色体提前凝集标本的方法。即让M 期细胞与间期(I 期)细胞融合,从而诱导I 期细胞染色质提前浓缩成染色体。形成的这种染色体称提前凝集的染色体(Prematurely Condensed Chromosome, PCC)。这项技术已应用于细胞周期分析、正常细胞和肿瘤细胞染色体的微细结构的研究、多种因素作用细胞使染色体损伤及修复效应的研究,预测某种血液病的病程、愈后及复发的临床实践等方面。
主要试剂
1. 50%PEG
2. Hanks 液(pH7.4)
3. RPMI-1640 培养基(含10%灭活小牛血清,pH7.4)
4. 10ug/ml秋水仙素
5. 0.075mol/L KCl 低渗液
6. 0.2%次甲基兰染液
7. 1/15mol/L PBS
8. Carnoy 固定液
9. Giemsa 染液
主要设备
1. 光学显微镜
2. 离心机
3. 水浴箱
4. 热吹风机
5. 10ml 刻度离心管
6. 5 号针头注射器
7. 试管架
8. 试管夹
9. 染色槽
10. 废液缸
11. 冰冻载玻片
12. 吸水纸
13. 擦镜纸
14. 香柏油瓶
15. 记号笔
16. 酒精灯
实验材料
人宫颈癌上皮细胞(Hela 细胞)
实验步骤
1. 收集培养的M 期Hela 细胞
1) 取一瓶处于对数生长期的Hela 细胞,向培养基中加入10ug/ml 的秋水仙素使终浓度为0.04ug/ml。
2) 在37℃二氧化碳培养箱中继续培养12h,使大量生长的细胞被阻断于M 期。
3) 每组取一瓶经上述处理的细胞,以平行于细胞生长面方向反复振摇,使培养液不断冲刷细胞层(或用吸管吹打),M 期细胞因变成球形容易脱离瓶壁而悬浮。
4) 将含有M 期细胞的培养基移入离心管中,1000rpm 离心5min。
5) 弃去上清,加入5ml Hanks 液,用吸管吹打成细胞悬液。
2. 收集培养的Hela 细胞
1) 取一瓶生长良好的Hela 细胞,弃去培养基。
2) 加入少量0.25%的胰蛋白酶消化2-3min,弃去胰酶消化液。
3) 加入5ml Hanks 液,用吸管吹打成单个悬浮细胞备用。
3. 50% PEG 的制备
1) 称取0.5g PEG(MW 4,000),倒入离心管中。
2) 在酒精灯上加热使之融化(约为0.5ml)。
3) 再加入预热的Hanks 液0.5ml,混匀,置37℃水浴中待用。
4. 细胞融合
1) 将上述两管细胞倒入一个离心管中充分混匀。1000rpm 离心5min,弃上清,再小心地吸尽残液。
2) 用指弹法弹散细胞,在37℃水浴条件下吸取0.5ml 50% PEG,逐滴加入离心管中,并不断地轻轻摇动,整个过程约90 秒钟。然后,迅速加入5ml Hanks 液以终止PEG 的作用。在37℃水浴中静置5min。
3) 1000rpm 离心5min,弃上清,加入2ml 含有血清的RPML-1640 培养基,同时用5 号针头的注射器垂直加入10ug/ml 的秋水仙素1 滴,轻轻吹打成悬液,37℃水浴中温育30~60min。
5. 制备PCC 标本
1) 细胞温育后,以1000rpm 离心5min,弃上清,加入10ml 0.075mol/L KCL 低渗液轻轻制成悬液。
2) 在37℃处理25min 左右,终止时加入1ml Carnoy 固定液进行固定。
3) 1000rpm 离心8min,弃上清,指弹离心管底部使细胞分散,加入10ml Carnoy 固定液固定30min。
4) 1000rpm 离心5min,弃去上清,留0.2ml 残液,用吸管轻轻吹打成悬液。
5) 取预冷的载玻片,制一张滴片,烤干。
6) Giemsa 染色15min 左右,水洗,干燥后镜检。
-
项目成果
-
项目成果